Introdução
- Apesar do enorme progresso ocorrido na área de engenharia e ciência dos materiais nos últimos anos, ainda há desafios tecnológicos, inclusive considerações sobre o impacto ambiental da produção dos materiais.
- A grande maioria dos engenheiros em algum ponto de sua carreira se deparará com algum problema de projeto envolvendo a seleção de materiais. Não existe um conjunto padrão de procedimentos a serem seguidos na escolha de materiais corretos para determinada aplicação. Cada situação é diferente e requer conhecimento sobre os materiais e sobre as condições às quais eles estarão sujeitos.
- Existem alguns pontos gerais que fornecem um ponto de partida para a escolha dos materiais:
- Qualquer material selecionado precisa possuir propriedades consistentes com as condições de serviço;
- É necessário considerar os efeitos das mudanças destas condições para fora dos limites da normalidade;
- Inicialmente, liste os materiais possíveis e então elimine alguns em função das características não adequadas em relação às propriedades, ou ainda, falta de segurança ou custo. Se os materiais restantes na lista não preencherem os requisitos há ainda algumas opções, tais como tratar os materiais de maneira apropriada (térmica ou quimicamente), mudar o ambiente de serviço, produzir uma liga que tenha os efeitos específicos desejados, etc.
Propriedades gerais dos materiais
- Este primeiro capítulo apresenta uma revisão sobre ligações químicas e conceitos básicos relacionados às propriedades elétricas, mecânicas, térmicas, químicas, etc.
- Nos capítulos seguintes, serão vistos os materiais condutores, semicondutores, isolantes e magnéticos.
- O átomo é composto por um núcleo circundado por elétrons. O núcleo é composto por prótons e nêutrons. Os elétrons são partículas carregadas e com 1/1836 da massa de um nêutron.
- A carga do elétron é convencionalmente negativa. Como os elétrons são componentes de todos os átomos, sua carga elétrica é freqüentemente tomada como unidade. Em unidades físicas, a carga do elétron vale 1,6 x 10-19 C.
Ligações Químicas
- Um próton possui uma carga que é numericamente igual a do elétron, só que de sinal oposto. Por exemplo, o átomo de hidrogênio, o mais simples de todos, é composto de um próton e de um elétron e é eletricamente neutro.
- De uma forma simplificada, um átomo de um certo elemento pode ser considerado como sendo uma combinação de prótons e nêutrons em um núcleo circundado por elétrons.
- Como a massa de um elétron é 0,0005 da massa de um próton ou de um nêutron, a massa total de um átomo é aproximadamente proporcional ao número de prótons e nêutrons no núcleo.
Massa do átomo = massa atômica / 6.02 x 10^23
- Com exceção da densidade e calor específico, o fator massa atômica exerce uma influência relativamente pequena sobre as propriedades dos materiais. O número de elétrons que circundam o núcleo de um átomo neutro é mais significativo. Este número, denominado número atômico, é igual ao número de prótons no núcleo.
Os elétrons que circundam o núcleo do átomo não têm todos o mesmo nível energético, sendo divididos em vários níveis, com propriedades energéticas diferentes (quatro números quânticos).
- As atrações interatômicas, forças que mantém os átomos unidos, também estão relacionadas à estrutura eletrônica dos átomos. Em um fio de cobre estas forças são fortes (caso contrário o metal se deformaria facilmente), já nos gases nobres, tais como He, Ne, A, etc. existe apenas uma pequena atração pelos outros átomos porque eles possuem um arranjo muito estável de oito elétrons (2 para o He) na sua camada mais externa, chamada de valência. A maior parte dos outros elementos, ao contrário dos gases nobres, deve adquirir a configuração altamente estável de oito elétrons na camada mais externa, através de um dos seguintes mecanismos:
Recebendo elétrons
Perdendo elétrons
Compartilhando elétrons
Ligação iônica
- Também chamada de eletrovalente, este tipo de ligação resulta da atração mútua entre íons positivos e negativos.
- Átomos de elementos como o sódio e cálcio, com um e dois elétrons na camada de valência, respectivamente, perdem facilmente estes elétrons externos e se tornam íons positivos. Por outro lado, os átomos de cloro e oxigênio facilmente recebem um ou dois elétrons na camada mais externa, respectivamente, de modo a completar oito elétrons nesta camada.
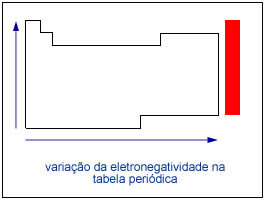
- À "força" que o átomo tem de capturar elétrons dos outros (vencer o "cabo de guerra"), damos o nome de eletronegatividade. Assim um átomo é fortemente eletronegativo quando tem facilidade em "roubar" os elétrons dos outros.
- Aproximando um átomo altamente eletronegativo de um de baixa eletronegatividade, ele captura elétrons tornando-se um íon negativo e tornando o outro um íon positivo. Como cargas elétricas opostas se atraem, eles ficarão ligados por atração eletromagnética e o tipo de ligação será chamada de ligação iônica.
- Na realidade uma carga negativa é atraída por todas as cargas positivas e uma carga positiva por todas as negativas.
- No sal de cozinha, por exemplo, as ligações entre os íons sódio e cloreto são iônicas, conseqüentemente os íons de sódio ficam envolvidos por íons cloreto, e os íons cloreto por íons de sódio Geralmente ligações iônicas se formam entre um metal e um ametal.
- O átomo do ametal tem uma configuração eletrônica semelhante a de um gás nobre, quase totalmente preenchida de elétrons. Eles tem alta eletronegatividade, e facilmente ganham elétrons formando um íon negativo ou ânion. Os dois ou mais íons logo se atraem devido a forças eletrostáticas. Ligações desse tipo são mais fortes que ligações de hidrogênio, e têm força similar às ligações covalentes.
- As ligações iônicas estão presentes nos cristais de sais inorgânicos (cloreto de sódio, cloreto de magnésio, fluoreto de lítio etc) e de certos compostos cerâmicos, tais como óxido de alumínio, óxido de magnésio etc.
Ligação Covalente
- Este tipo de ligação é muito comum na maioria das moléculas orgânicas e é outro tipo de ligação forte e estável. Se aproximarmos dois átomos de forte eletronegatividade, um não terá força para capturar o elétron do outro permanentemente. Ele captura o elétron, mas o outro consegue capturá-lo de volta e, além de retomá-lo, captura um elétron do outro.
- Esse “jogo” fica se repetindo fazendo com que o par de elétrons (um de cada átomo) fique orbitando pelos dois átomos. É importante perceber que nesse caso não há formação de íons. Esse tipo de ligação, onde não há transferência definitiva de elétrons, e sim compartilhamento do par, resultando em uma distribuição eletrônica mais estável, é designada por ligação covalente.
- Ligações covalentes normalmente ocorrem entre átomos com eletronegatividades similares e altas (geralmente entre dois não-metais), dos quais remover completamente um elétron requer muita energia
- A ligação covalente implica em intensas forças de atração entre os átomos, o que é evidenciado, por exemplo no diamante, que é o material mais duro encontrado na natureza e inteiramente constituído por carbono. Outra demonstração da força desta ligação covalente (onde cada átomo compartilha seus 4 elétrons da camada de valência com 4 átomos adjacentes) também pode ser percebida pela temperatura extremamente elevada (>3000o. C) a que pode ser aquecido antes da destruição da sua estrutura.
- Numa ligação covalente ideal, os pares de elétrons são igualmente compartilhados. No caso da água, ocorre uma transferência parcial de carga fazendo com que o hidrogênio fique levemente positivo e o oxigênio levemente negativo. Este compartilhamento desigual resulta numa ligação “polar”
- Somente nos casos onde os dois lados da molécula são idênticos, como no H2 e no N2, a ligação é totalmente apolar. A ligação entre átomos distintos tem sempre algum grau de polaridade. Nas ligações covalentes observa-se também um comprometimento total dos elétrons das últimas camadas dos átomos envolvidos.
Ligação Metálica
- A ligação metálica é outro tipo de atração interatômica forte
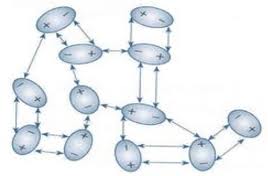
- Se um átomo apresenta apenas uns poucos elétrons de valência, estes podem ser removidos com relativa facilidade, enquanto que os demais elétrons são firmemente ligados ao núcleo. Isto origina uma estrutura formada por íons positivos e elétrons “livres”, como pode ser visto na figura a seguir.
- Este tipo de ligação é peculiar dos metais, como o próprio nome indica. Os metais têm um, dois ou no máximo três elétrons de valência.
- Estes elétrons fracamente presos ao núcleo não estão ligados a um único átomo, mais estão mais ou menos livres para se movimentar por todo o metal, formando o gás eletrônico.
- A ligação metálica (ligação entre metais) não pode ser explicada nem pela ligação covalente nem pela iônica, configurando-se como um tipo específico e diferenciado de ligação entre átomos. Diferente. de um sólido onde os átomos estão muito próximos uns dos outros e que a maioria desses sólidos apresenta os elétrons bem presos aos seus átomos, na ligação metálica, os elétrons mais externos, por se encontrarem muito distantes do núcleo, movimentam-se livremente, formando um mar de elétrons dentro do retículo cristalino.
- Efetivamente, podemos definir a ligação metálica como “retículo de esferas rígidas (cátions) mantidas coesas por elétrons que podem se mover livremente – elétrons livres (‘mar de elétrons’).
- A movimentação desses elétrons livres explica a condutividade elétrica e térmica característica dos metais
- Quando aquecemos uma barra de metal, promovemos a agitação entre os átomos que as formam, fazendo com que os elétrons aumentem suas oscilações e a energia se propague aos átomos mais internos. Isso acontece porque os elétrons livres se chocam com os átomos mais velozes e aceleram os mais lentos, servindo como meio de propagação de calor
- Assim, a condutibilidade (elétrica ou térmica), própria dos metais, depende do número de elétrons livres no cristal.
- Os átomos de um metal, assim ligados estão distribuídos de tal maneira, que seus íons se posicionam segundo uma configuração cristalina regular. Este tipo de ligação interatômica é peculiar dos metais, que constituem cerca de três quartos dos elementos existentes. Apenas uma oitava parte dos elementos são “não metais” (a outra oitava parte são os metalóides).
- São os elétrons livres, resultantes da ligação metálica, que concedem aos metais suas principais características:
- alta condutividade elétrica e térmica
- opacidade
- brilho superficial
- deformabilidade plástica.
Ligações Secundárias
- Existem também forças secundárias que ligam moléculas umas às outras. São secundárias porque os valores das energias de ligação são muito menores que aqueles valores encontrados nas ligações covalente, metálica e iônica. Essas ligações secundárias são resultantes de atrações eletrostáticas de dipolos.
- Estas ligações são fracas em relação às outras. Estas forças aparecem a partir dos dipolos atômicos ou moleculares. Os dipolos elétricos existem sempre que existir alguma assimetria entre as partes positivas e negativas dos átomos e moléculas.
- A ligação resulta da atração coulombiana entre um pólo positivo e a região negativa do adjacente. Apesar de uma molécula de água ser eletricamente neutra como um todo, a distribuição de carga pela molécula não é uniforme. Esta força pode ser atrativa em relação a outros grupos similares, por exemplo, íons hidroxila (OH-) em moléculas orgânicas que atraem moléculas de água.
- Estas forças são conhecidas como ligações de hidrogênio e existem em algumas moléculas que têm o hidrogênio como um dos seus constituintes. Outro Exemplo de ligações secundárias são as forças de Van der Waals (forças devido a polarização das moléculas).
Questões
- 1. Porque razões a água não é considerada como ligação iônica?
- Adriel
- 2. Qual a característica marcante dos Ametais?
- Túlio Del Claro
- 3. O que é Afinidade Eletrônica?
- Nyalla
- 4. Qual a relação entre eletronegatividade e raio atômico?
- Amanda
- 5. Como funciona a Ligação Covalente Dativa?
- Lucas Borges
- 6. Como é possível ter covalëncia de 4 elétrons? Que característica marcante gera essa ligação?
- Lucas Manuel
- 7. Exemplifique algumas ligas metálicas, explicando sua composição e aplicações.
- Vitor Campos
- 8. Como funciona a força de coesão nos metais e qual sua relação com a fusão?
- Gabriel Zanatta
- 9. Cite as 3 características principais dos compostos moleculares?
- Rafael Gil
- 10. Como eu determino o caráter de uma ligação?
- Gabriel Cardoso
- 11. Desenhe a fórmula estrutural (Lewis) para o Trióxido de Alumínio.
- Isabela