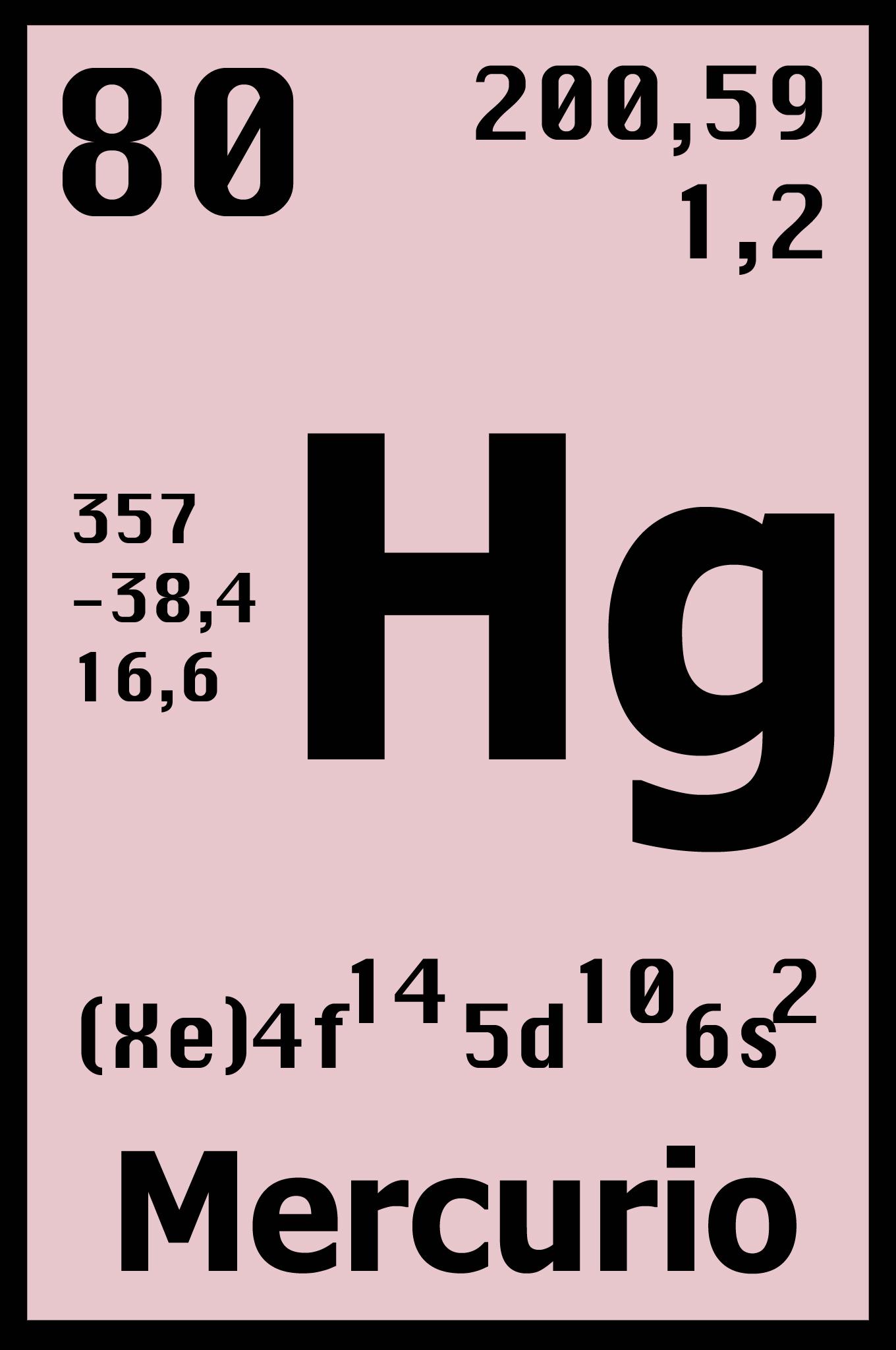MERCÚRIO
- Estado
- Mercúrio é um metal líquido à temperatura ambiente. O símbolo Hg vem do grego "hydrargyrum" que significa prata líquida.
- O mercúrio é um elemento químico de número atômico 80 (80 prótons e 80 elétrons) e massa atómica 200,5 u.
- Condutividade
- Pela sua boa condutibilidade elétrica é usado em contatos elétricos; em forma de vapor encontra-se em tubos de fluorescência de descarga elétrica e para gerar raios ultravioleta.
- Em geral, a condutividade térmica de uma substância é maior na fase sólida e menor na gasosa. Já a condutividade térmica dos líquidos decresce com o aumento da massa molar, e metais líquidos como o mercúrio têm alto valor de condutividade térmica e são bastante adequados para o uso em aplicações nas quais a alta taxa de transferência de calor para o líquido é desejada, como em usinas nucleares.
- Resistividade
- O mercúrio apresenta resistividade igual a 0,95 Ω . mm²/m a 20°C.
- Em 1911, o físico holandês Heike Onnes, um dos pioneiros no desenvolvimento de técnicas para o resfriamento de materiais, pesquisou a resistividade elétrica do mercúrio e percebeu que esse material perdia a sua resistência elétrica de forma completa e abrupta ao ser resfriado abaixo de 4K (-269ºC). Ele denominou "supercondutividade" esse estado de resistência zero.
- Coloração
- Líquido Prateado.
- Oxidação
- O mercúrio metálico ou elementar, no estado de oxidação zero (Hg0) existe na forma líquida à temperatura ambiente, é volátil e liberta um gás monoatómico perigoso: o vapor de mercúrio. Este é estável, podendo permanecer na atmosfera por meses ou até anos, revelando-se, deste modo, muito importante no ciclo do mercúrio, pois pode sofrer oxidação e formar os outros estados: o mercuroso, Hg+1, quando o átomo de mercúrio perde um elétron e o mercúrico, Hg+2, quando este perde dois elétrons.
- Dano a saúde humana
- O mercúrio e os seus compostos são venenosos. Para o Homem é particularmente perigoso aspirar os vapores de mercúrio durante um tempo prolongado. Momentaneamente não se percebe o dano, mas após alguns anos começa a ocorrer perda de cabelo e outros sintomas de envenenamento. Deve-se por este motivo ter cuidado, sobretudo nos laboratórios.
- Ao contrário de outros líquidos, evapora-se tão lentamente que pode continuar presente durante décadas, emitindo constantemente uma pequena quantidade de vapor venenoso.
- Origem
- A principal matéria-prima para a obtenção do mercúrio é o cinábrio (HgS - sulfeto de mercúrio), que, por aquecimento intenso sob uma corrente de ar, produz mercúrio na forma de vapor e dióxido de enxofre. O mercúrio, uma vez condensado por resfriamento com água, é purificado por filtração através de camurça e, caso seja necessário, por destilação ou tratamento com ácido nítrico diluído.
- As maiores reservas de cinábrio se encontram na Espanha.
Aplicações
- Na indústria, as utilizações mais comuns do metal estão na fabricação de termômetros, barômetros, amálgama dentário e em vários outros equipamentos científicos.
- Já o mercúrio-cromo e o mercurobutol são empregados como anti-séptico em ferimentos. Dissolve facilmente o ouro, prata, chumbo e metais alcalinos formando ligas relativamente consistentes.
Engenharia Elétrica
- Lâmpadas de Vapor de Mercúrio. Tubo de descarga de quartzo. Formação de arco elétrico entre o eletrodo de partida (auxiliar) e o eletrodo principal, formando vapor de mercúrio e ionização de gás, até estabilização.
- Lâmpadas para iluminação pública e para grandes ambientes.
- Eficiência luminosa: 50 lm/watt
- Vida útil aproximada: 18.000 horas, enquanto que uma lâmpada incandescente tem vida útil de 2.000 horas.
- Pilha de mercúrio
- 1,35 V
- Longa vida útil, podem ser guardadas por muito tempo (10 anos)
- Grande capacidade de suportar condições ambientais severas
- Desvantagem do preço e danoso à saúde
- Relógios, calculadoras, marca-passos, aparelhos auditivos, máquinas fotográficas e brinquedos.
- Em 1936, foi construída a primeira linha comercial de corrente contínua em alta tensão (CCAT), usando uma válvula de arco de mercúrio, entre Schenectady e Mechanicville no estado de Nova Iorque. A CCAT tinha já sido obtida através da instalação em série de geradores de corrente contínua (Sistema Thury), mas sofria de problemas de fiabilidade.
Ligas
- O mercúrio forma ligas com diferentes metais, designadas por amálgamas. Um exemplo conhecido é uma amálgama com aproximadamente 70% de mercúrio, 3% de cobre, 1% de zinco e 26% de estanho. Esta liga endurece poucos minutos depois de fazer a mistura e utiliza-se para fazer pastas dentífricas.
- Principais Amálgamas:
- Amálgama de Sódio: é a mistura de Sódio metálico com mercúrio. Utilizado na fabricação de lâmpadas de sódio e em química orgânica como agente redutor.
- Amálgama de Alumínio: Também utilizada como agente redutor em química orgânica.
- Amálgama de Prata: Mistura de prata, cobre e estanho com mercúrio, usado em restaurações odontológicas.
- Amálgama de Estanho: Superfícies refletoras de espelhos
- Amálgama de Ouro: liga de ouro com mercúrio utilizado na extração de ouro, evapora-se o mercúrio e obtém-se o ouro puro.
- Amálgama de Tálio: Utilizado na fabricação de termômetros de baixas temperaturas, pois seu ponto de congelamento é menor que o do mercúrio.
Curiosidades
- Único metal líquido nas condições ambiente.
- Aqui no Brasil a intoxicação de mercúrio ocorre com maior frequência que em outros países, porque o garimpo clandestino nos rios da Amazônia utiliza o mercúrio para separar impurezas, e depois separa-se o ouro do mercúrio, pelo aquecimento e fundição do metal.
- Parte deste mercúrio vai de volta aos rios, e o peixe, que é muito curioso, ingere aquele metal brilhante, que logo vai impregnar suas carnes, que, a partir daí, já não servem para consumo humano.
- Outra forma de contaminação por mercúrio são os detritos industriais jogados nos rios, contaminando as folhas de verduras hortaliças. Isso pode ser detectado, por exemplo, nos exames de metais pesados de pessoas vegetarianas ou daquelas que fazem a dieta do Mediterrâneo.
- Tiocianato de mercúrio (II) (Hg(SCN)2) é um composto químico. Já foi usado em show pirotécnicos devido à serpente de faraó, a cinza em forma de serpente que é gerada quando uma bolinha do material é inflamada.
http://www.youtube.com/watch?v=2l7v0CVH6iA
Resumo
- Seu nome tem origem grega, uma homenagem aos deuses, uma vez que era conhecido como prata dos deuses. É o único metal líquido à temperatura ambiente.
- Aquecido, oxida-se rapidamente em contato com o ar. É usado em termômetros resistivos para leituras entre 0 e 100oC, bem como para chaves basculantes usadas conjuntamente com sistemas mecânicos, sobretudo de relógios, em retificadores, lâmpadas (vapor de mercúrio).
- Seu principal uso no ramo da Engenharia Elétrica é o contato elétrico através do vapor de mercúrio, que, por sua baixa resistividade, conduz muito bem a corrente elétrica.
- Quase todos os metais (com exceção do ferro e do tungstênio) se dissolvem muito bem no mercúrio. Essa característica permite que o mercúrio forme diversas ligas, chamadas de amálgama, cujas aplicações são muitas, desde antissepsia, uso odontológico, superfícies refletoras de espelho até agente redutor em reações orgânicas.
- Os vapores de mercúrio são venenosos. Se inalados durante um tempo prolongado, causam intoxicação grave, levando mesmo até à morte. Como o mercúrio é um líquido estável, sua evaporação é lenta, e onde há mercúrio, haverá vapor durante muito tempo.
- Na área dos retificadores, seu uso caiu acentuadamente com a evolução do retificador de silício. Mesmo em pilhas e lâmpadas, tem-se tentado substituir seu uso devido à sua periculosidade à saúde humana.
Referência bibliográfica
http://pt.wikipedia.org/wiki/Merc%C3%BArio_(elemento_qu%C3%ADmico)
http://www.infopedia.pt/$mercurio;jsessionid=xqsFweQkRqHIa9YqcnAkCg__
http://www.infoescola.com/quimica/amalgama/
http://www1.folha.uol.com.br/folha/equilibrio/equi20000802_miner10.shtml